تثبیت آنزیم
(Immobilization of Enzymes)
مقدمه
آنزیم ها کاتالیست های زیستی با اندازه نانومتری هستند که قابلیت کاربردی فراوان و شناخته شده ای دارند. درگذشته، معمولاً از آنزیم ها در صنایع، به ویژه در فرایند تولید شوینده ها، استفاده می شد. در حال حاضر، آنزیم ها در زمینه های جدیدی مانند سنتز شیمیایی خالص، داروسازی، حسگر زیستی، حذف زیستی آلاینده ها، جداسازی زیستی، فرایند PCR، هضم پروتئین ها در کاتالیز پروتئومیک و پیل های سوختی زیستی کاربرد گسترده ای یافته اند. اختصاصی بودن آنزیم ها قابلیت کاربردی فراوان آن ها را سبب شده، اما در حال حاضر، طول عمر کوتاه آنزیم ها استفاده از آن ها را محدود کرده است (خسروی و همکاران، 1391). آنزیم ها ترکیبات نسبتا ناپایداری هستند که هزینه خالص سازی آن ها بالاست و زمانی که بصورت محلول در واکنش ها مورد استفاده قرار می گیرند، بازیافت آن ها از مخلوط واکنش بسیار مشکل خواهد بود. مشکل اصلی آن ها، حساس و شکننده بودن آن ها نسبت به شرایط سخت محیطی است که منجر به این امر می شود که نیمه عمر عملکردی آنزیم کاهش بیابد. بهترین و موفق ترین روش برای غلبه بر این مشکل، تثبیت آنزیم است (Ashly و همکاران، 2011). بهبود پایداری آنزیم می تواند کاربرد های عملی آن را بیشتر کند. افزایش پایداری آنزیم می تواند موجب کاهش مقدار مصرفی آنزیم ها، افزایش طول عمر راکتورهای آنزیمی، افزایش شانس استفاده دوباره از آنزیم، و نیز حصول سیگنال قوی تر در حسگر زیستی شود. برای افزایش پایداری آنزیم ها روش های مختلفی وجود دارد، اعم از: تثبیت آنزیم، اصلاح آنزیم، مهندسی پروتیئن، و مهندسی محیط پیرامون آنزیم ها (خسروی و همکاران، 1391).
تثبیت آنزیم
در فرایند تثبیت آنزیم، مولکول های آنزیم از طریق جذب فیزیکی یا اتصالات کووالانسی بر روی ساختاری با سطح زیاد متصل شده و یا درون ژل یا ساختارهای میکروکپسول، ریز پوشانی می شوند. به طور خاص اتصال از چند نقطه بین آنزیم و ماده یا سطح مورد استفاده برای تثبیت، جلوی باز شدن ساختار در هم پیچیده مولکول پروتئین را می گیرد و در نتیجه، پایداری افزایش می یابد. کریستال های آنزیمی با اتصالات عرضی (CLECs) و تجمع های آنزیمی با اتصالات عرضی (CLEAs) بر پایه اتصالات بین چندین نقطه از مولکول های (یا کریستال های) آنزیم هستند (خسروی و همکاران، 1391).
فواید تثبیت آنزیم
آنزیم تثبیت شده در مقایسه با آنزیم آزاد بدلیل برخورداری از مزایای چشمگیری مانند، پایداری بیشتر ، کاربرد پیوسته آنزیم، بازیابی آنزیم، حجم کمتر واکنش، کنترل بهتر و بازدهی بالاتر واکنش، خلوص بیشتر محصول، کاهش آلودگی محیط، صرفه اقتصادی و استفاده از بیوکاتالیست تثبیت شده در گستره وسیعی از انواع بیوراکتورها روز به روز مورد توجه بیشتری قرار می گیرد (تقی زاده، 1387).
هدف از تثبیت، افزایش مقاومت آنزیم در شرایط شدید درجه حرارت، pH و حلال های آلی، بازیافت و استفاده مجدد از آنزیم است. با وجود این مزایا، کاربردهای صنعتی آن به دلیل هزینه های بستر، محدودیت های انتقال جرم، نگرش سنتی، تغییر در خواص (عملکرد اختصاصی)، از بین رفتن فعالیت در طی تثبیت محدود شده است.
روش های تثبیت آنزیم
در یک تثبتی کارآمد باید فاکتورهای متفاوتی در نظر گرفته شود تا ضمن دستیابی به بهترین توازن میان میزان پایداری و فعالیت، فرایند با کمترین هزینه ممکن انجام شود. امکان تثبیت آنزیم ها با حامل های مختلف توسط روشهای مختلفی صورت می گیرد. معمولاً ارجحیت با روشی است که کمترین صدمه را به آنزیم وارد می کند. و در این میان سیستم های با سهولت و امنیت بیشتر و هزینه کمتر ایده آل می باشند و روش محبوس کردن تا حد زیادی این نیاز را در غالب موارد تامین می کند (تقی زاده، 1387).
همانطور که بیان شد، روش های متنوعی جهت بهبود فعالیت و پایداری آنزیم ها برای کاربرد در حضور حلال های آلی به کار گرفته می شوند. اغلب روش های تثبیت به دسته های زیر تقسیم می شوند که هر کدام مزایا و معایب خود را دارند (Beatriz و همکاران، 2006) :
1- جذب سطحی
1-1- تثبیت با جذب غیر کووالانسی
1-2- تثبیت از طریق فعل و انفعالات یونی
1-3- تثبیت با اتصالات کووالانسی
2- تثبیت بوسیله اتصال عرضی آنزیم ها
3- تثبیت از طریق به دام انداختن آنزیم
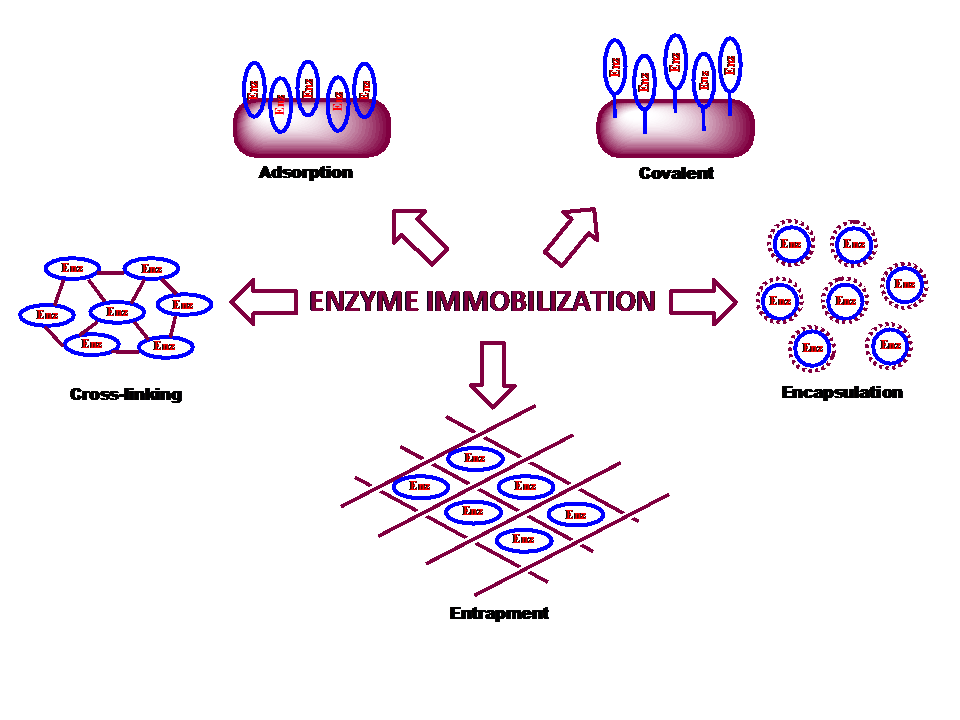
حامل ها در روش های مختلف تثبیت آنزیم
1- جذب سطحی
1-1- تثبیت با جذب غیر کووالانسی: سیلیکا، نانولوله های کربنی، سلولز و …
1-2- تثبیت از طریق فعل و انفعالات یونی: پلی ساکارید ها و پلیمر های سنتزی دارای بخش های تبادل یونی
1- 3- تثبیت با اتصالات کووالانسی: پلیمرهای حاوی گروه های آمین، کربوکسیل، سولفیدریل، هیدروکسیل یا فنلی
2- تثبیت بوسیله اتصال عرضی آنزیم ها: حامل ندارد و خود آنزیم ها پس از متصل شدن به صورت حامل عمل می کنند، عواملی مانند گلوتارآلدهید در اتصال نقش دارند.
3- تثبیت از طریق به دام انداختن آنزیم: در یک ژل پلیمری (ماتریکس ) یا کپسول (غشا) صورت می گیرد.
مزایا و معایب روش های مختلف تثبیت آنزیم
1- تثبیت با جذب غیر کووالانسی (جذب سطحی)
جذب آنزیم ها بر روی حامل ها می تواند از طریق فعل و انفعالات مختلفی صورت گیرد. آنزیم های دارای سطوح لیپوفیل بالا اتصال خوبی با یک حامل هیدروفوب ایجاد می کنند. نیروهای واندروالسی و تغییرات آنتروپی، تثبیت آنزیم بر روی حامل را تضمین می کند. باقیمانده های قندی آنزیم های گلیکوزیله شده می تواند جذب از طریق پیوندهای هیدروژنی را اطمینان بخشد و مناطق سطحی هیدروفیلیک زیادی از آنزیم با حامل هیدروفیل واکنش می دهند.
مزیت تثبیت بوسیله تاثیرات آنتروپی یا پیوندهای هیدروژنی این است که آنزیم پیش تیمار نشده و از نظر شیمیایی تغییری نمی کند. همچنین امکان استفاده از آنزیم خام در این نوع تثبیت وجود دارد.
عیب مهم تثبیت توسط جذب سطحی این است که آنزیم تمایل دارد هنگام استفاده از محیط های آبی از حامل نشت کند؛ که البته اگر حلال های آلی استفاده شوند، بدلیل ماندگاری ذاتی آنزیم ها در چنین محیط هایی، این موضوع حائز اهمیت نیست (Pahujani و همکاران، 2008).

2- تثبیت از طریق فعل و انفعالات یونی (جذب سطحی)
بسته به pH و نقطه ایزوالکتریک محلول، ممکن است سطح آنزیم دارای بار باشد. با به کار گیری سیستم های مدل سازی می توان توزیع و بار سطحی آنزیم ها را تعیین نمود (Minovska و همکاران، 2005). هر مبدل یونی می تواند از طریق واکنش های قطبی و یونی به عنوان یک حالم در تثبیت آنزیم ها عمل کند. بسته به بار اصلی آنزیم، مبدل های یونی به صورت منفی (نظیر کربوکسیلات) یا مثبت (گروه های آمینی پروتون دار) باردار می شوند. فعالیت و عملکرد انتخابی آنزیم ها بسته به pH و دمای به کار رفته در حین فرایند تثبیت متفاوت است که این امر بدلیل یونیزاسیون آنزیم حین فرایند تثبیت است.
مثالی از این نوع تثبیت آنزیم بنزآلدهید لیاز است که از طریق کمپلکش ایمیدازول و نیکل متصل به پلی وینیل پیرولیدون به عنوان ماتریکس تثبیت شده و می تواند چندین بار برای تشکیل بنزوئین مورد استفاده قرار گیرد.
آنزیم بنزآلدهید لیاز به همراه زنجیره اش از طریق حامل اصلاح شده با نیکل تثبیت شده و تشکیل بنزوئین را کاتالیز می کند.
نقش ساختارهای متخلخل سیلیکات در عمل تثبیت
سیلیکات های متخلخل از پیش ساز سیلان با استفاده از سورفاکتانت سنتز می شوند که ساختاری متخلخل با توزیع اندازه منافذ ریز دارند. قطر منافذ از طریق نوع سورفاکتانت و شرایط آزمون از 2 تا 25 نانومتر متغیر است. این ساختارهای متخلخل سیلیکات امکان جذب و یا به دام انداختن مولکول های زیستی بزرگی را درون منافذ فراهم می آورند. بسته به بار آنزیم، گروه های عمگرا نظیر آمین و کربوکسیلات درون ساختار جهت تسهیل جذب آنزیم با حفظ فعالیت آن افزوده می شوند. این گروه ها بایستی با قطر دهانه منافذ سیلیکات متناسب باشند تا امکان عملکرد مناسب سیلیکات در جذب و حفظ آنزیم فراهم شود.
ساختار مختلخل تامین کننده محیطی محافظ و پوششی برای آنزیم بوده و در آنجا واکنش آنزیم با سوبستراهای انتخابی با به حداقل رسیدن معایبی مانند پراکندگی انجام می گیرد. برای مثال استفاده از تریپسین تثبیت شده در سیلیکات های متخلخل برای هضم مقداری از پروتئین ها صورت گرفته است و بدین طریق نفوذ سوبسترا درون منافذ با محدودیت همراه نبوده است. همچنین در تحقیق دیگری آنزیم کلروپراکسیداز بر سیلیکات متخلخل تثبیت و نقش حفاظتی سیلیکات به عنوان یک عامل نگهدارنده بررسی گردید. این آنزیم اکسیداسیون گروه های عملگرای بسیاری نظیر اپواکسیداسیون آلکن ها را کاتالیز می کند (Beatriz و همکاران، 2006).
3- تثبیت با اتصالات کووالانسی (جذب سطحی)
پیوند کووالانسی آنزیم به حامل دارای این مزیت است که آنزیم به صورت محکمی ثابت شده و بدین ترتیب امکان شستشوی آن در محیط آبدار به حداقل رسیده و آلودگی پروتئینی محصول رخ نمی دهد.
در قالب یک قانون کلی، تثبیت کووالانسی بایستی هنگام کار در محلول آبدار و زمانی که عوامل دناتوره کننده وجود دارند ترجیح داده شود. دلیل آن تشکیل چندین پیوند کووالانسی بین آنزیم و حامل و کاهش انعطاف پذیری و ارتعاشات حرارتی حامل و همچنین ممانعت از باز شدن پروتئین و دناتوراسیون می باشد.
مزیت دیگر این است که به طور کلی آنزیم های تثبیت شده به صورت کووالانسی را می توان در هر محیطی به کار برد در حالیکه آنزیم های جذب شده بایستی در حلال های آلی یا در واکنش دهنده های هیدروفوبیک خالص جهت ممانعت از شسته شدن مورد استفاده قرار داد .
عیب آشکار پیوند کووالانسی این است که آنزیم به لحاظ شیمیایی دچار تغییر گشته و همچنین با وجود اینکه اتصال چند نقطه ای آنزیم ها می تواند سبب پیوند محکم آن ها به حامل گردد، تثبیت یکنواخت و منظمی برای همه مولکول های آنزیم رخ نمی دهد. این عامل محدود کننده تنها برای آنزیم های مونومری (دارای یک زیر واحد) نمی باشد بلکه انواع مولتی مری (دارای چند زیر واحد) را نیز شامل می شود (Dong و همکاران، 2012).

4- تثبیت بوسیله اتصال عرضی آنزیم ها
یک مورد پرکابرد از اتصال کووالانسی، اتصال عرضی آنزیم ها با به کار گیری عواملی نظیر گلوتارآلدهید می باشد. به جای تثبیت آنزیم به یک حالم، آنزیم خود به عنوان یک حامل عمل می کند. مرحله نخست، تهیه کریستال ها یا توده های آنزیمی به شکل خشک شده به کمک خشک کن پاششی می باشد. با این روش آنزیم های موجود در محلول را نیز می توان اتصال عرضی نمود .
در این روش آنزیم تثبیت شده فاقد حامل بوده و همانند آنزیم خالص فاقد مزایا و معایب مرتبط با حامل ها می باشد. افزودن رسوب دهنده هایی مانند استن، سولفات آمونیوم، اتانول و یا 1 و 2 دی متوکسی اتان در پی یک عامل اتصال دهنده عرضی نظیر گلوتارآلدهید نیز انجام می گیرد.
لیپاز BLC با سرم آلبومین گاوی به عنوان عامل پشتیبان و در حضور دکسترین اتصال عرضی می شود که توده های حاصل نسبت به نوع تجاری و معمولی آن و همپنین نسبت به ژل خشک لیپاز فعالیت بیشتری دارند.
البته یک کاتالیست باید پس از واکنش بدون تغییر باقی بماند و قابلیت بازیابی مجدد را داشته باشد که در مورد توده های آنزیمی که به صورت عرضی به هم متصل شده اند، این مورد رخ نمی دهد.
5- تثبیت از طریق به دام انداختن در یک ژل پلیمری یا کپسول
بهترین ابزار برای ممانعت از هر گونه تاثیر منفی بر ساختار یک آنزیم ریزپوشانی نمودن (انکپسوله کردن) آن است. روش های زیادی برای این عمل وجود دارند که در این بین روش سل-ژل بهترین و پرکاربردترین روش می باشد. سل- ژل ها مواد سیلیکایی هستند که بسیار متخلخل هستند و به سهولت تهیه می شوند. سل – ژل ها به لحاظ شیمیایی خنثی هستند و پایداری مکانیکی و حرارتی بالایی دارند اما به صورت طبیعی شکننده می باشند. این مواد به صورت گسترده در تثبیت پروتئین ها و بخصوص در تولید بیوسنسورها مورد استفاده قرار می گیرند (Beatriz و همکاران، 2006).


یک کاتالیزگر در طی واکنش، سرعت رسیدن به تعادل را بدون اینکه در واکنش مصرف شود، افزایش می دهد. با این تعریف یک کاتالیزگر باید قابل بازیافت باشد. اگر یک کاتالیز گر، چه از نوع آنزیمی و چه از هر نوع دیگری در محیط واکنش حل شود، اغلب بازیابی آن دشوار است، چه رسد به استفاده مجدد از آن. بنابراین تثبیت کاتالیز گر می تواند یک راه ساده برای بازیافت آن کاتالیست باشد (Beatriz و همکاران، 2006).
بسیاری از آنزیم ها به صورت تجاری در دسترس هستند. قیمت ها بسته به درجه سختی جداسازی آنزیم و یا آسانی بدست آوردن آن ها از منابع نوترکیب می تواند به صورت قابل توجهی متفاوت باشد. بعضی از آن ها به قدری ارزان هستند که در پودرهای شوینده و کاربردهای فله ای دیگر استفاده می شوند.
توضیحات تکمیلی
آنزیم ها حساس، ناپایدار و قابل استفاده در محیط های آبی هستند که این ویژگی ها برای یک کاتالیز گر، غیر ایده آل و در بسیاری از سنتز ها نامطلوب است. در بسیاری از موارد، یکی از راه های جلوگیری از این مشکلات تثبیت انزیم است. از آنجایی که تثبیت آنزیم امکان فراوری متناوب در کاربرد در مقیاس های صنعی را ایجاد می کند، راه مناسبی است. از طریق فرایند تثبیت آنزیم، آنزیم ها بدلیل پایداری حساسیت کمتری نسبت به محیط خود دارند. فرایندهایی که در آن ها از آنزیم های نا محلول معلق در محیط های آبی آبگریز استفاده می شود، برای بهینه سازی پراکندگی آنزیم به منظور بهبود دسترسی به سوبسترا و همچنین جلوگیری از تجمع ذرات هیدروفیل پروتئین نیازمند تثبیت هستند. علاوه بر این، تثبیت امکان بازیافت را تضمین می کند. تثبیت آنزیم بر روی یک جامد نامحلول باید ساده و مقرون به صرفه باشد. تثبیت آنزیم به استفاده از آنزیم کمک می کند ولی باید به طور جداگانه ای برای هر مورد مطالعه صورت گیرد.
تثبیت یک آنزیم مستلزم تعامل دو گونه آنزیم و حامل بوده و بنابراین ویژگی های سطحی هر دو مهم است. در مورد آنزیم، گروه های قطبی (مانند گروه های آمینی روی لیزین یا گروه های اسیدی روی گلوتامیک اسید)، مناطق سطحی غیر قطبی یا بخش های قندی می توانند خواص سطحی را تحت تاثیر قرار دهند. حامل می تواند برای مطابقت با هر کدام از این خواص سحطی آنزیم، آماده شود. نیاز ضروری برای هر حاملی، داشتن ناحیه سطحی بالاست. این را می توان از طریق ذرات با اندازه کوچک بدست آورد، هر چند این باعث می شود جدایی دشوار شود، و یا با مواد بسیار متخلخل با منافذی با ابعاد به اندازه کافی بزرگ که نفوذ سوبستراها را محدود نمی کند، بدست آورد. علاوه بر این مواد باید به صورت شیمیایی و مکانیکی پایدار باشند (Pahujani و همکاران، 2008).
در روش انکپسوله کردن آنزیم درون حامل، منافذ باید اندازه مناسبی داشته باشند تا نفوذ سوبسترا بدون مانع تضمین شود و همچنین اطمینان حاصل شود که این آنزیم در داخل حبس شده است. اتصال آنزیم به حامل را می توان با اتصال کووالانسی تقویت نمود. فعال کردن مجدد گروه های عملکردی می تواند به وسیله انتخاب مونومر آلی مناسب بر روی ماتریکس حامل پلیمری صورت گیرد. در مورد سیلیکات، مشتقات سطحی را می توان از طریق تغییر گروه های هیدروکسی سطحی با معرف مناسب بدست آورد. در موارد شدید اتصال، حاملی استفاده نمی شود و مولکول های آنزیم به یکدیگر متصل شده و خود حامل را تشکیل می دهند.
چند مورد از نتایج تحقیقات صورت گرفته
چند مورد از نتایج تحقیقات صورت گرفته در این رابطه به شرح زیر است:
- لیپاز قلیایی خارج سلولی از Bacillus coagulans بر روی Nylon-6 فعال شده با گلوتارآلدهید توسط پیوندهای کووالانسی تثبیت شده است. آنزیم تثبیت شده 88% از فعالیت اولیه خود را در دمای 55 درجه سانتی گراد به مدت 2 ساعت حفظ کرد. همچنین 85% فعالیت اولیه پس از 8 دوره هیدرولیز باقی ماند (Dong و همکاران، 2012).
- آلفا آمیلاز هیدرولیز کننده نشاسته را توسط جذب فیزیکی و پیوند کووالانسی بر روی پلیمرهای پلی آنیلین (PINAs) در دو شکل متفاوت نمک امرالدین و پودر قلیایی امرالدین تثبیت کردند. قابلیت نگهداری آنزیم تثبیت شده تا 6 ماه افزایش یافت در حالی که آنزیم آزاد فعالیت خود را در طی 8 روز از دست داد. قابلیت استفاده مجدد از آنزیم نیز افزایش یافت (Ashly و همکاران، 2011).
- لیپاز حاصله از پانکراس را بر روی ارگانوبنتونیت تثبیت کردند. لیپاز تثبیت شده مقاومت به حرارت و pH بیشتر و همچنین فعالیت هیدرولیزی بالاتری نسبت به لیپاز آزاد بر روی روغن زیتون داشت. بعد از 8 روز نگهداری، فعالیت اولیه آنزیم تثبیت شده 7/2 برابر آنزیم آزاد بود و بعد از 6 بار استفاده متوالی 5/82% از فعالیت اولیه آن باقی ماند (Minovska و همکاران، 2005).
نتیجه گیری کلی
با اینکه تثبیت آنزیم ها به مقدار زیادی به روش آزمون و خطا انجام می شود، در تثبیت هدفمند آنزیم ها پیشرفت هایی حاصل شده است. پیشرفت های اخیر در طراحی مواد با اندازه منافذ و عملکرد سطحی مناسب، کنترل دقیق تری از روند تثبیت با حفظ فعالیت کاتالیتیکی و پایداری ارائه می دهد. در حالی که شبیه سازی ویژگی های سطحی آنزیم هدف می تواند برای کمک در طراحی مواد حامل مناسب استفاده شود، مثال های مربوط به روش های شبیه سازی مولکولی برای پیشرفت منطقی استراتژی های تثبیت شده محدود می باشد. از آن جایی که ساختار و مکانیسم بیشتر آنزیم ها در دسترس است، روش های تثبیت کنترل شده تری ایجاد می شود. لازم به ذکر است که حتی در مواردی که ساختار سه بعدی آنزیم موجود نیست، مدل های ساختاری را می توان با استفاده از روش مدلسازی همسانی ساخت. مثال های آنزیم های تثبیت شده ای که ذکر شده نشان می دهد که انتخاب روش تثبیت را نمی توان به سادگی با معیاری که بالاترین ثبات و فعالیت آنزیم را نشان می دهد، تعیین کرد بلکه باید واکنش خاص و مشخصی را که قرار است کاتالیز شود، در نظر گرفت. بطور کلی، کاربردهای موفقیت آمیز بیوکاتالیزورهای صنعتی نیاز به سیستم هایی دارد که نه تنها پایدار و فعالند بلکه کم هزینه هستند و می توانند به طور مکرر مورد استفاده شوند (سعیدی و همکاران، 1392).
منابع:
تقی زاده پارچه بافی؛ بهاره (1387)، بررسی سینتیک تثبیت آنزیم آلفاآمیلاز در پلیمر کتیرا، هجدهمین کنگره علوم و صنایع غذایی، صص 1-9.
خسروی، آرزو؛ وثوقی، منوچهر؛ شاهرخیان، سعید؛ عالم زاده، ایران (1391)، کاربرد فناوری نانو در پایدار سازی آنزیم ها، ماهنامه فناوری نانو، سال یازدهم، شماره 5، پیاپی 178، صص 22-25.
سعیدی، درنا؛ سرابندی، خشایار؛ مومنی، ندا (1392)، بررسی روش های تثبیت آنزیم ها، ویژگی ها و مزایا، بیست و یکمین کنگره ملی علوم و صنایع غذایی ایران، صص 1-5.
Ashly P.C., Joseph M.J. and Mohanan P.V. (2011). Activity of diastase a-amylase immobilized on polyanilines (PANIs). Food Chemistry, 127: 1808–1813.
Dong H., Li J., Li Y., Hu L. and Luo D. (2012). Improvement of catalytic activity and stability of lipase by immobilization on organobentonite. Chemical Engineering Journal, 181–182: 590–596.
Minovska V., Winkelhausen E. and Kuzmanova S. (2005). Lipase immobilized by different techniques on various support materials applied in oil hydrolysis. Journal of the Serbian Chemical Society, 70: 609–624.
Pahujani S., Kanwar Sh.S., Chauhan G. and Gupta R. (2008). Glutaraldehyde activation of polymer Nylon-6 for lipase immobilization: Enzyme characteristics and stability. Bioresource Technology, 99: 2566–2570.
Beatriz M. Brena and Francisco Batista-Viera (2006) Immobilization of Enzymes, A Literature Survey, Methods in Biotechnology: Immobilization of Enzymes and Cells, Second Edition. Edited by: J. M. Guisan © Humana Press Inc., Totowa, NJ.
 پایگاه علمی سعید سان دانلود رایگان مقالات علمی کنفرانس و ژورنال
پایگاه علمی سعید سان دانلود رایگان مقالات علمی کنفرانس و ژورنال
